A quoi servent les analyses de laboratoire ?
- Valider et complémenter les observations faites directement sur le terrain
- Comprendre la composition biogéochimique d’un sol ainsi que l’arrangement, l’organisation et l’interaction des composants du sol
- Répondre à une question de recherche ciblée
Principe et utilité
Une analyse laboratoire va fournir un résultat isolé et réductionniste, sur une propriété ou composante spécifique du sol. Mais comme on l’a vu à travers l’exploration de ce site, le fonctionnement d’un sol est le résultat d’interactions complexes entre une multitude de facteurs qui interagissent à différentes échelles de temps et d’espace. Souvent, les analyses de laboratoire sont complémentaires entre elles et il est donc nécessaire, lorsque l’on veut comprendre le fonctionnement d’un sol, de combiner les différents résultats obtenus dans une approche holistique ou le sol, objet d’étude, est remis dans son environnement global. La bonne compréhension d’un sol découle donc d’une succession de zoom avant et zoom arrière qui consiste à appréhender un élément isolé et précis puis de le remettre dans son contexte au sein des autres facteurs qui interagissent avec lui directement ou indirectement au sein du sol.
Les analyses laboratoires sont généralement coûteuses; il convient donc de bien réfléchir à quelles analyses faire. Ce choix va dépendre de la question que l’on se pose. Chaque méthode analytique permet de dévoiler une facette du sol. Une fois que les questions de recherche sont posées et que les analyses permettant d’y répondre ont été choisies, il s’agira de bien comprendre le principe de l’analyse et surtout de pouvoir interpréter les résultats.
Vidéo de présentation du type d’analyses de laboratoire qui sont effectuées sur des échantillons de sols. Présenté par Fabienne Dietrich, doctorante 2017, Institut des dynamiques de la surface terrestre, Université de Lausanne
Liens vers les résultats des analyses laboratoires :
But des différentes analyses laboratoires
Préparation d’un échantillon de sol
Tout échantillon de sol prélevé sera marqué de manière à pouvoir être facilement identifiable une fois au laboratoire (lieu, sol, horizon/profondeur, date du prélèvement). Il sera d’abord séché à l’air dans une étuve à 45°C pendant environ une semaine (selon l’humidité qu’il contient). Puis il sera tamisé à 2mm afin de séparer la fraction grossière de la terre fine. C’est principalement sur la terre fine que les analyses sont faites. Certaines analyses requièrent un échantillon broyé à la taille des limons (farine), d’autres sont faites directement sur la terre fine tamisée à 2mm. En effet, le broyage du sol implique une modification de la surface spécifique des particules le constituant, qui voient leur granulométrie diminuer. Le broyage se fait à l’aide d’un mortier en agate (à cause de sa dureté et composition chimique simple – SiO2 – ne risquant pas de contaminer l’échantillon broyé avec d’autres éléments), soit à la main ou avec un mortier automatique en fonction de la quantité d’échantillon et du volume de terre à broyer.
Humidité résiduelle
Tout échantillon séché à l’air contiendra toujours une part d’humidité résiduelle (HR), soit piégée principalement dans la fraction argileuse et la matière organique par capillarité, soit dû à l’humidité relative de l’air environnant. Cette HR n’est donc pas fixe et varie selon l’humidité de l’air et la composition de l’échantillon. De manière à être reproductibles et comparables entres elles, les analyses laboratoires doivent donner une mesure caractérisant la phase solide. Il convient donc de mesurer l’HR (séchage à 105°C pendant minimum 48 heures, puis pesée de la différence de poids avant et après le passage au four) d’un échantillon afin de pouvoir ensuite corriger certains résultats en leur soustrayant la proportion pondérale que représente l’HR. De cette manière, différents résultats exprimés peuvent être comparés entre eux de manière plus robuste. De plus, l’HR ne sert pas uniquement à corriger les résultats d’autres analyses mais elle est aussi informative en soi. En effet, elle délivre déjà une bonne indication du contenu en argiles et matière organique d’un échantillon.
Perte au feu, matière organique et carbone organique
La perte au feu (PAF) consiste à calciner un échantillon à 450°C et de mesurer la différence de poids avant et après calcination. Cette mesure regroupe la perte de la matière organique, de l’humidité résiduelle ainsi que de l’eau de constitution des minéraux argileux. Elle est communément utilisée en science du sol pour déterminer de manière approximative et rapide la quantité de matière organique et de carbone organique présent dans un échantillon. Pour mesurer la matière organique, un facteur de correction sera appliqué sur les résultats de la PAF afin de tenir compte de l’eau de constitution piégée dans les minéraux argileux et relâchée durant la PAF. De même, la communauté scientifique s’accorde sur le fait que le carbone organique représente environ 58% de la matière organique. Une mesure de la matière organique permet donc d’estimer la quantité de carbone organique. La perte au feu peut aussi être appliquée à 1050°C. A cette température, tous les carbonates, s’il y en a, sont détruits et une part de leur masse est relâchée sous forme de CO2.
Analyse élémentaire CHN, rapport C/N
Cette analyse, faite sur sol broyé, permet de mesurer la quantité totale de carbone (C) et d’azote (N) dans un échantillon (ces éléments étant trop légers pour être mesurés à la XRF, cf. description ci-dessous). Si les échantillons ne contiennent pas de carbonate, la mesure de carbone correspond au carbone organique (Corg), et permet donc de connaître la quantité de matière organique dans l’échantillon. Cette mesure permet aussi de calculer le rapport C/N, pour autant que la mesure de carbone corresponde au carbone organique (et non pas au carbone des carbonates). Le rapport C/N est un indicateur de fertilité et de fonctionnement du sol communément utilisé depuis longtemps par les agronomes, les agriculteurs et les forestiers. Il est utilisé principalement pour les horizons de surface qui sont organo-minéraux et donne une indication du degré d’évolution de la matière organique, c’est-à-dire de sa tendance à se décomposer et à se minéraliser (selon les conditions environnementales). Un C/N élevé indiquera une mauvaise décomposition de la matière organique par manque d’azote alors qu’un rapport faible sera le signe d’une décomposition rapide de la matière organique et d’une abondance d’azote.
pH
Le pH est une mesure de la concentration en protons (H+), ions H3O+ dissociés. Elle se fait dans une solution liquide, par exemple de l’eau distillée ou dans un sel (CaCl2 ou KCl). Une certaine quantité de sol tamisé est mélangé à la solution choisie et la concentration en ions dissociés est mesurée. Dans une solution d’eau, une part des protons (sous forme non dissociée) vont rester attachés à la phase solide du sol, spécifiquement aux argiles et à la matière organique, et ne seront pas libérés dans la solution. Ce pHeau mesure donc l’acidité actuelle du sol. Alors que dans une solution saline, les ions Ca2+ ou K+, vont prendre la place des protons fixés sur le complexe et les libérer dans la solution. Dans les sols de nos régions, dont l’altération est peu avancée, une mesure de pH dans une solution saline donnera normalement des valeurs de pH plus basses, donc indiquant un pH plus acide. La différence entre le pH mesuré dans l’eau ou dans une solution saline donne une indication de l’acidité potentielle d’un sol. Cette différence peut aussi être mesurée entre le pH d’une solution saline peu concentrée (par exemple CaCl2 à 0.01M) et le pH d’une solution saline très concentrée (par exemple KCl à 1M). La mesure de pH dans une solution saline concentrée est une meilleure indication de l’acidité d’un sol dans le temps.
Capacité d’échange cationique
La capacité d’échange cationique (CEC) permet de mesurer la quantité de cations fixés sur le complexe adsorbant d’un sol à pH donné. C’est une mesure qui n’est pas constante dans le temps: elle varie en fonction du complexe adsorbant, des cations disponibles ainsi que du pH. Elle donne une bonne indication de la fertilité d’un sol et permet de mesurer le taux de saturation (rapport S/T). En général, différents complexes adsorbants auront plus ou moins de sites pour l’adsorption de cations présents dans la solution du sol. Étant donné que le complexe adsorbant est principalement composé d’argiles, différents types de minéraux argileux auront des CEC variables en fonction de leur structure.
Calcaire total et calcaire actif
La mesure du calcaire ou carbonates de calcium (CaCO3) total permet d’évaluer l’avancement de la décarbonatation d’un sol calcaire. En général, on observe un gradient avec une accumulation de calcaire en profondeur, signe de l’avancée de la décarbonatation. Le calcaire actif, quant à lui, est une bonne indication de la fertilité d’un sol. En effet, le calcaire total ne donne aucune indication quant à la taille des carbonates; or l’on sait que ce sont les particules les plus fines (et non les sables) qui sont réactives. Pour la nutrition des plantes, c’est le calcaire sous forme réactive qui est importante car c’est sous cette forme qu’il peut être absorbé par la végétation.
Granulométrie
La granulométrie fournit la répartition (sous forme de proportion pondérale) des particules minérales inférieures à 2mm. La répartition classique en pédologie comprend trois ou cinq classes (argiles – limons fins ou grossiers – sables fins ou grossiers), selon des limites de taille communément acceptées par les pédologues (voir la figure 1 ci-dessous). Mais il est tout à fait possible de subdiviser le continuum granulométrique de manière plus détaillée selon la question de recherche.
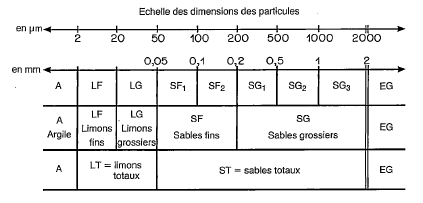
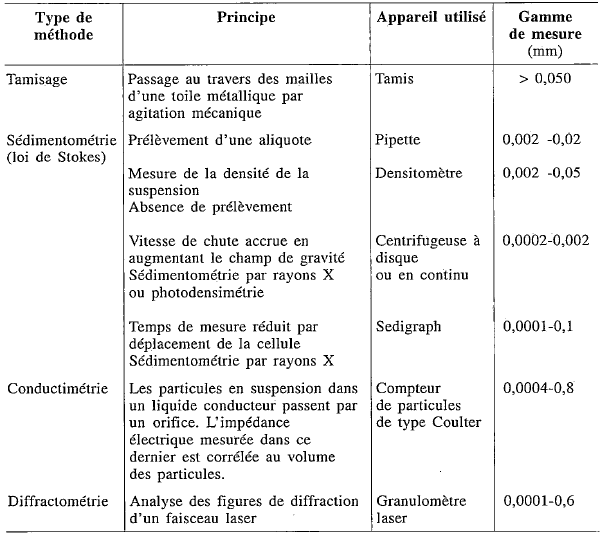
Afin de pouvoir mesurer la taille de ces particules minérales, il est nécessaire de déstructurer l’échantillon afin d’obtenir la juste proportion des particules minérales. Pour ce faire, les agrégats ainsi que la matière organique doivent être complètement détruits. Les agrégats seront détruits mécaniquement sur une table de mixage ou à l’ultrason si les ciments du sol sont très consolidés (par exemple dans les sols tropicaux riches en fer et en aluminium) et maintenus dispersés grâce à l’ajout d’un dispersant chimique. Cette étape n’est généralement pas nécessaire pour les sols tempérés. Puis la matière organique sera digérée à l’aide d’un réactif chimique (par exemple par le peroxyde d’oxygène (H2O2), connu sous le nom d’eau oxygénée). Si l’échantillon contient des carbonates, il peut être également décarbonaté (étape à questionner selon la question de recherche, par exemple pas recommandée pour une analyse agronomique). Une fois l’échantillon réduit sous forme de particules minérales élémentaires, la mesure de la taille des particules peut être faite. Il existe différentes techniques, mentionnées dans la figure 2 ci-dessous.
Diffraction aux rayons-X (XRD)
La diffraction aux rayons-X est une méthode qui permet de fournir la minéralogie d’un échantillon. Comme son nom l’indique, cette méthode est basée sur la diffraction de rayons-X bombardés sur les plans atomiques des réseaux cristallins. Elle donne une mesure de la proportion relative des minéraux bien cristallisés présents dans un échantillon. Les minéraux cryptocristallins (mal cristallisés) ne seront pas mesurés car leur cristallisation irrégulière ne rendent pas d’angle de diffraction spécifique. De même, les matériaux amorphes (tel que les oxydes d’aluminium) ne diffractent peu ou pas les rayons-X. L’ensemble de ces minéraux et oxydes mal cristallisés seront regroupés dans une classe spécifique nommée « indosés » dans la fiche de données ci-dessus. Il conviendra donc, si nécessaire, de faire d’autres analyses permettant d’identifier cette fraction peu cristalline mais étant la plus réactive dans un sol. De même, la méthode classique appliquée sur les échantillons broyés et pressés dans une pastille ne permettra pas de donner précisément la minéralogie des argiles. Celles-ci seront regroupées sous une même classe, les phyllosilicates (les argiles minéralogiques). Il est cependant possible d’obtenir la minéralogie individuelle des argiles via l’analyse XRD, mais ceci implique un protocole de préparation de l’échantillon spécifique, différent de la méthode des pastilles pressées.
Fluorescence aux rayons-X (XRF)
L’analyse XRF en science du sol est principalement faite sur les éléments majeurs, c’est-à-dire les éléments qui constituent le 95 % de la croûte terrestre (Si, Al, Ca, Mg, Na, K, Ti, Fe, Mn et P). Les résultats sont présentés sous forme de proportions poids relatives. Ils représentent la quantité totale de l’élément donné indifféremment de son état ou phase chimique (libre, amorphe, piégé dans un réseau cristallin, etc). Un telle analyse élémentaire donne une indication de l’ambiance géochimique du sol et de son matériel parental, mais elle peut également renseigner sur le degré d’altération (rapport entre élément facilement lixivié, comme le Ca / élément immobile, comme le Ti). Ces données peuvent également être précieuses lorsqu’on souhaite connaître les proportions d’un élément sous une forme qui nous intéresse (par ex. P biodisponible / P total). Il est également possible de déterminer la quantité (donnée généralement en ppm) des éléments traces (par ex. Ba, Cu, Mn, Pb, Sr, Zn). Ces derniers peuvent être intéressants pour des questions relatives à la pollution des sols ou pour retracer le type de matériel parental par exemple.
Extractions sélectives à l’ammonium-oxalate (AmOx) et au citrate-bicarbonate-dithionite (CBD)
Ces deux extractions chimiques permettent de quantifier des phases minérales secondaires libérées lors de processus pédogénétiques (dissolution et (re-)précipitation). Elles visent respectivement les phases minérales cryptocristallines (ex. matériel de type immogolite, ferrihydrite,…) pour l’extraction AmOx et les oxydes d’Al (ex. gibbsite) et de Fe (ex. goethite, hématite) pour l’extraction CBD. Les deux réactifs utilisés solubilisent les phases souhaitées lors d’une digestion contrôlée, puis les éléments sont dosés par spectrométrie (ICP). En général, des métaux tels que l’aluminium, le fer et le silicium sont analysés. Selon la question de recherche, le phosphore peut également être quantifié. Ces analyses donnent de bons indicateurs sur l’avancée de la pédogenèse, étant donné qu’elles renseignent sur la nature et la quantités de phases minérales secondaires. Il est important de garder en tête que ces extractions dissolvent également d’autres phases minérales ou organiques du sol, comme la silice amorphe ou les métaux associés à des complexes organo-minéraux. Afin d’interpréter correctement les résultats de ces analyses, il est impératif de lire de la littérature à ce sujet. Par ailleurs, il existe d’autres extractions ciblant des phases différentes.
