©Keystone/Science Photo Library/ Russell Kightley
Au cours de leur évolution, les virus ont développé des stratégies astucieuses pour pénétrer dans les cellules humaines, puis pour détourner leur machinerie afin de se multiplier. La lutte passe par l’élaboration de médicaments qui ciblent les différentes étapes du cycle de leur vie.
Variole, rougeole, grippe espagnole et, plus récemment VIH, Ebola ou Zika. Les virus figurent aux premiers rangs des «périls qui ont frappé l’humanité au cours de son histoire», souligne Stefan Kunz, professeur de virologie fondamentale à l’UNIL et responsable d’un groupe de recherche à l’Institut de microbiologie de l’UNIL et du CHUV. Incapables de survivre seuls, ils infectent des cellules-hôtes – végétales, animales ou humaines – au sein desquelles, en véritables parasites, ils se développent et se reproduisent.
Sortis de nulle part
Seul l’un de ces microbes pathogènes, le responsable de la variole, a été éradiqué de la surface de la planète (lire aussi: Des virus et des Hommes, une longue cohabitation). Les autres, pour la plupart, poursuivent leurs ravages, tout particulièrement dans les pays peu développés. Et comme si cela ne suffisait pas, on assiste périodiquement à l’émergence de nouveaux venus, certains «sortis de nulle part, comme le virus Ebola», dit Stefan Kunz, ou d’autres, comme le Zika, qui était déjà connu de quelques experts, mais qui ne s’était pas manifesté jusque là. «Si, en 2012, un an avant l’épidémie qui a éclaté en Polynésie française, on m’avait demandé de nommer un virus émergent qui commence par un Z et finit par un A, j’aurais été incapable de répondre», constate le chercheur qui est pourtant un spécialise du domaine. Selon l’OMS (Organisation mondiale de la santé), cent cinquante-quatre nouvelles maladies virales ont été découvertes entre 1940 et 2004.
Des infections souvent transmises par des animaux
Parmi ces infections émergentes connues, précise le chercheur de l’UNIL, «60% sont des zoonoses», c’est–à-dire qu’elles nous ont été transmises par des animaux. «A un moment donné, ces microorganismes ont franchi la barrière des espèces», passant des animaux chez lesquels ils sont inoffensifs, aux êtres humains chez lesquels ils provoquent des infections souvent mortelles.
C’est ainsi que dans un lointain passé, «le virus de l’hépatite C nous a été transmis par les chevaux qui ont été parmi les premiers animaux à être domestiqués». La construction de villages, de routes et de chemins de fer dans des lieux encore vierges de présence humaine a aussi mis les populations en contact direct avec des espèces qu’elles n’avaient jamais côtoyées auparavant, ce qui a favorisé la transmission virale. C’est de cette manière qu’à la fin du XIXe siècle, le virus du sida, le VIH, est passé du chimpanzé à l’homme en Afrique. «Les activités humaines ont donc joué un grand rôle dans cette dynamique», constate le virologue.
Elles ne sont toutefois pas les seules et les microbes ont leur part de responsabilité dans l’affaire. Certains d’entre eux circulent en permanence à la surface de la Terre et ils évoluent: ils subissent des mutations ou des réarrangements génétiques qui augmentent leur virulence et les rendent très pathogènes. C’est un phénomène de ce type qui a provoqué la pandémie de grippe espagnole durant l’hiver 1918-1919.

Nicole Chuard © UNIL
Virus de Lassa: des fièvres hémorragiques foudroyantes
La lutte contre ces dangereux agents pathogènes est donc encore loin d’être terminée. Pour élaborer des vaccins et des médicaments susceptibles de combattre ces microbes, il est nécessaire de connaître la manière dont ils infectent les cellules, afin de tenter de bloquer leur action au cours des différentes phases de leur cycle de vie. C’est un long travail de ce type qu’ont entrepris les virologues de l’UNIL qui se sont focalisés sur le virus de Lassa. Ce microorganisme, qui provoque des fièvres hémorragiques foudroyantes, constitue, selon Stefan Kunz, une «véritable menace pour la santé publique». Il infecte en effet chaque année plus de cent mille personnes et provoque le décès de milliers d’entre elles en Afrique occidentale où il sévit. «Les pays les plus touchés – la Guinée, le Liberia, le Nigeria et la Sierra Leone – sont d’ailleurs les mêmes que ceux qui avaient été frappés par les épidémies de fièvre Ebola», précise le chercheur.
Ce microorganisme appartient à la famille des arenavirus, qui tire son nom de arena, sable en latin, car lorsqu’il est observé au microscope électronique, il a un aspect granuleux. «La particule virale est d’une grande simplicité, puisqu’elle ne renferme que quatre gènes. C’est incroyable et déprimant de penser qu’elle peut tuer un être humain dont la complexité génétique est mille fois plus élevée.»
Comme la tristement célèbre peste noire du Moyen-Age, le virus de Lassa trouve son réservoir naturel chez des rats (Mastomys). Il suffit alors aux humains de respirer les poussières issues des excréments contaminés des rongeurs pour être infectés à leur tour. Avec des conséquences souvent tragiques. Au départ, «les symptômes sont peu spécifiques et ils ressemblent à ceux de n’importe quelle infection virale», précise Stefan Kunz. Toutefois, dans 10 à 20% des cas, la maladie s’aggrave et «elle cause des œdèmes et des hémorragies auxquelles elle doit son nom». A un stade tardif, elle provoque des états de choc et défaillances rénales et hépatiques entraînant la mort.
Le pronostic dépend en fait de la quantité de virus présente dans l’organisme. «Les personnes qui ont une charge virale élevée, de l’ordre de 1 million de particules virales par millilitre de sang, ont un haut risque de décéder, alors que celles qui ont une charge virale plus faible ont une grande probabilité de survivre, constate le virologue. Cela nous donne une opportunité pour agir.» Il n’existe en effet aucun vaccin contre la fièvre de Lassa et le traitement, qui utilise «un antiviral à large spectre (la ribarivine) n’est pas suffisamment efficace quand il est administré seul. Il est donc nécessaire d’élaborer des médicaments qui ciblent différentes étapes du cycle viral afin de donner au système immunitaire la possibilité de contrôler le pathogène.»
Pénétrer dans la cellule
Pour infecter son hôte, le virus doit franchir une première barrière: il doit pénétrer dans les cellules humaines. Celles-ci, à l’image d’une place forte du Moyen Age, sont en effet entourées d’une muraille – leur membrane – qui les isole de leur environnement. Il lui faut donc d’abord trouver une porte d’entrée et, telle une clé adaptée à une serrure, un récepteur sur lequel il se fixe. Tous les virus pathogènes fonctionnent ainsi et, en général, le récepteur en question est une protéine. Mais le virus de Lassa procède différemment, comme l’a découvert l’équipe lausannoise en collaboration avec celle de Kevin P. Campbell de l’Université de l’Iowa (Etats-Unis). Pour s’ancrer dans les tissus avoisinants, ce qu’on appelle la matrice extracellulaire (MEC), la cellule possède un récepteur, le dystroglycane. Celui-ci est rendu fonctionnel par des chaînes de sucres – qui lui sont ajoutées par une enzyme, nommée LARGE – sur lesquelles le virus s’accroche.
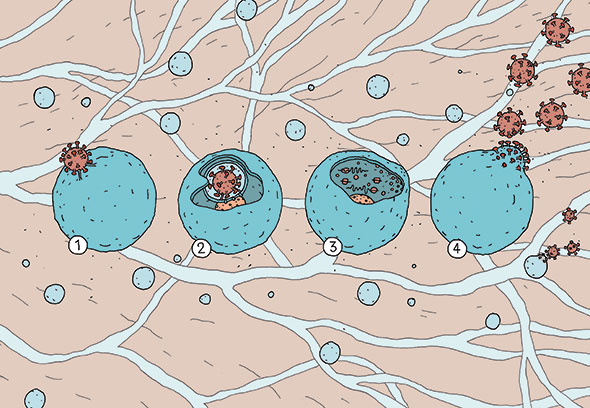
(1) Le virus (en rouge) se fixe à la membrane de la cellule-hôte (en bleu) au sein de laquelle il pénètre profondément (2). Une fois en place, il reproduit ses différents composants (réplication) grâce à la machinerie de la cellule et les assemble, créant une nouvelle particule virale (3). Celle-ci sort alors de la cellule – qui ne meurt pas – tout en emportant une partie de son enveloppe (bourgeonnement) et va infecter des cellules voisines (4). Les tailles relatives du virus et de la cellule ne sont pas à l’échelle. Illustration Jehan Khodl.
«Le microorganisme parvient à mimer cette MEC. Mais il fait beaucoup mieux qu’elle», explique Stefan Kunz. Il se fixe au récepteur dix fois plus solidement et «il est ainsi capable de repousser la matrice extracellulaire et de la percer». C’est ce qui explique que les microbes qu’une personne a inspirés puissent pénétrer si facilement dans ses poumons. Une spécialiste de biologie de l’évolution de l’Université de Harvard a d’ailleurs constaté que les habitants d’Afrique de l’Ouest étaient porteurs d’une variante de LARGE qui est unique et que l’on ne retrouve pas ailleurs sur la planète. «Le virus infecte ces humains depuis plus de 1000 ans et il a donc eu un impact sur l’évolution de leur ADN, commente le chercheur de l’UNIL. Notre hypothèse est que cette variante de LARGE protège les populations contre le virus de Lassa, de la même manière que certains groupes sanguins préservent de la malaria.»
Le virus se comporte comme un cheval de Troie
Une fois le virus fixé à la paroi cellulaire, «il presse sur la sonnette», explique Stefan Kunz dans un langage imagé. En d’autres termes, il envoie à la cellule des signaux – qui prennent la forme de protéines que les chercheurs lausannois ont identifiées – qui facilitent et préparent le processus lui permettant de pénétrer dans les profondeurs de la cellule-hôte. Une fois arrivé dans la ville convoitée, le microorganisme «se retrouve dans un labyrinthe dans lequel il doit trouver son chemin». Tel un «cheval de Troie», il est aidé par les habitants de la cité qui viennent à sa rescousse et le guident. «C’est un exemple flagrant qui montre que le virus est capable de communiquer avec la cellule, qu’il a bien appris son langage.» Aux dépens des êtres humains infectés.
«A l’issue de presque dix ans de travail, nous avons identifié plusieurs facteurs cellulaires, des protéines, qui servent de signaux de guidage», souligne le professeur de l’UNIL. Ce sont autant de cibles thérapeutiques potentielles susceptibles de bloquer la progression du pathogène vers les profondeurs de la ville conquise.
Car une fois arrivé au but, le virus se livre à «un véritable piratage de la cellule-hôte dont il utilise la machinerie biosynthétique. Il peut alors produire et assembler tous les composants dont il a besoin pour former une nouvelle particule virale.»
Cette dernière sort alors de la cellule-hôte par bourgeonnement, c’est-à-dire en arrachant au passage des morceaux de sa membrane. Cela lui permettra d’envahir encore plus facilement l’ensemble de l’organisme. Le processus est d’autant plus aisé pour l’envahisseur que «la cellule infectée ne meurt pas». Elle peut donc servir d’usine de fabrication pour les pathogènes.
Empêcher le pathogène de se reproduire
A ce stade, la maladie s’est déclarée et l’ennemi est déjà dans la place. Il est donc inutile de vouloir lui en bloquer l’entrée et pour le déloger, «il faut chercher une nouvelle cible thérapeutique. A cette fin, explique Stefan Kunz, nous avons choisi de nous attaquer à une étape tardive de la vie du virus.» Son équipe a donc entrepris d’empêcher le virus de s’assembler et de sortir de la cellule-hôte.
Pour franchir en sens inverse les murailles de la ville, le microorganisme doit se munir d’une armure spéciale: une glycoprotéine. Celle-ci est produite «sous une forme inactive par la machinerie biosynthétique de la cellule-hôte et nous avons découvert que le virus lui-même n’est pas capable de l’activer. Pour ce faire, il a besoin d’une enzyme humaine, une convertase, qu’il réussit à abuser.» Ainsi armé, le virus devient infectieux.
Les chercheurs de l’UNIL ont utilisé une substance neutralisant l’activité de cette protéase et le résultat est spectaculaire. «Lorsque cet inhibiteur est mis en présence de cellules infectées, il bloque la propagation du virus. Les particules virales sont toujours là, mais elles sont nues et non infectieuses. Elles ne peuvent donc pas se propager dans l’organisme.»
Les convertases, dont il existe toute une famille, «font partie de nos cellules et elles jouent un rôle clé», constate le virologue. Elles sont d’ailleurs non seulement utilisées par le virus de Lassa, mais aussi par tous les arenavirus. En outre, «elles sont liées au métabolisme du cholestérol» et l’on sait que des mutations génétiques de ces enzymes sont associées à une hypercholestérolémie. Par ce biais, «elles interviennent dans diverses pathologies majeures, comme les maladies cardiovasculaires, quelques affections héréditaires et les cancers. En dehors de la virologie, elles constituent donc des cibles thérapeutiques très prometteuses pour ces maladies.»
Un outil pour la recherche
Si la glycoprotéine qui décore l’enveloppe du virus de Lassa est nécessaire à la reproduction du pathogène, elle peut aussi fournir aux biologistes et aux médecins un outil fort utile. Une fois encore, la glycoprotéine virale fait mieux que les substrats humains, car elle se fixe plus solidement à la convertase. «Elle peut donc être utilisée comme sonde moléculaire», constate le chercheur. Il suffit en effet de lui associer un «gène rapport» qui émet un signal luminescent pour voir, d’un seul coup d’œil, si elle est activée et il est même possible de mesurer son niveau d’activation. «Cela nous donne la possibilité de disposer de tests, très simples et bon marché, pour le diagnostic des maladies dans lesquelles la convertase intervient.» Autre avantage, on peut introduire cette sonde dans des cellules humaines et regarder si des substances susceptibles d’activer ou d’inhiber les convertases sont, ou non, efficaces. C’est ce que l’on nomme du «criblage à haut débit».
L’équipe de l’Institut de microbiologie est aussitôt passée à l’action. «En quatre jours seulement, nous avons pu tester les mille quatre cents molécules contenues dans une banque chimique.» Il s’agit en fait de médicaments déjà commercialisés pour traiter diverses pathologies et qui pourraient, aussi, être utilisés pour lutter contre la fièvre de Lassa ou d’autres maladies courantes impliquant la fameuse convertase. Juste retour des choses: le virus tueur pourrait lui-même donner aux chercheurs de nouvelles armes pour le combattre.



