© Institut de microbiologie UNIL-CHUV
Ces organismes microscopiques, qui vivent en équilibre avec l’être humain, peuvent devenir de redoutables pathogènes. Les maladies fongiques tuent chaque année plus de 1,5 million de personnes dans le monde – plus que le paludisme. Un phénomène d’autant plus inquiétant que ces champignons développent des résistances aux médicaments. Notamment à cause de l’utilisation de fongicides dans l’agriculture.
Lorsqu’on évoque les champignons mortels, on songe aussitôt aux amanites phalloïdes. Rien à voir avec les tueurs qui inquiètent chercheurs et médecins. Au même titre que les virus et les bactéries, ce sont des organismes microscopiques – ils ne mesurent qu’une dizaine de micromètres, soit dix fois moins qu’un cheveu. Mais certains d’entre eux peuvent devenir de véritables pestes. Pour les plantes, puisque «si l’on n’utilisait pas de fongicides, un cinquième des réserves végétales alimentaires de la planète serait détruit», souligne Dominique Sanglard, professeur associé à l’Institut de microbiologie de l’UNIL et du CHUV. Pour certaines espèces animales dont ils provoquent l’extinction, ils sont notamment «le principal tueur des batraciens».
Ils n’épargnent pas non plus les êtres humains. Les maladies fongiques tuent entre 1,5 et 2 millions de personnes chaque année dans le monde, constate le microbiologiste qui y voit «un véritable problème de santé publique».
Des aspects positifs
«Nous avons toujours vécu avec les champignons, constate le professeur de l’UNIL qui tient à souligner qu’ils ont aussi des vertus. Les plantes, avec lesquelles ils vivent en symbiose, ont besoin d’eux pour croître de manière optimale.» Ils dégradent aussi la matière organique et jouent un rôle important dans les composts. Sans compter que, pour se défendre, ils produisent des molécules «dont on a tiré de nombreux médicaments, à commencer par la pénicilline, le premier antibiotique utilisé, mais aussi «des substances faisant baisser le taux de cholestérol ou des immunosuppresseurs».
Certaines espèces, dites commensales, vivent d’ailleurs en bonne entente avec notre organisme qu’elles ont colonisé. Elles forment notre mycobiote qui représente notamment 10% de la flore intestinale. Toutefois, ces micro-organismes au départ inoffensifs deviennent pathogènes chez les individus dont le système immunitaire est affaibli, voire supprimé. C’est le cas des patients qui ont eu subi «une transplantation d’organe ou un traitement anticancéreux». Mais aussi celui des porteurs du VIH (car ce virus s’attaque directement aux défenses immunitaires), ou encore des personnes ayant eu «un traitement antibiotique à long terme, car la destruction des bactéries facilite la colonisation par les champignons». Le nombre de personnes à risque augmentant, partout dans le monde, «l’incidence des infections fongiques croît dans les milieux hospitaliers», constate Dominique Sanglard qui considère que «c’est le prix à payer pour les avancées de la médecine».

Nicole Chuard © UNIL
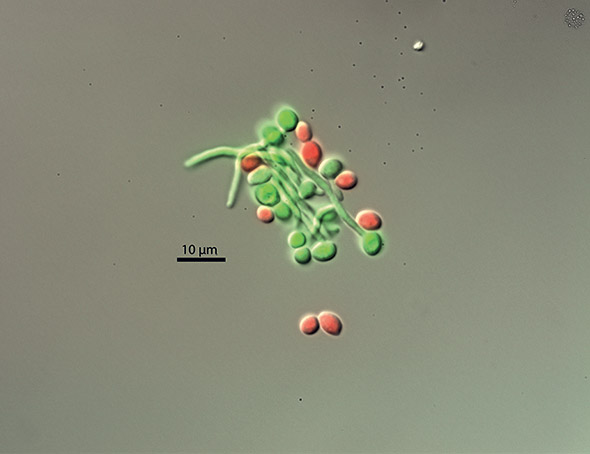
Candida albicans: «Dr Jekyll et Mr Hyde»
«On estime qu’il existe environ un million d’espèces de champignons, précise Dominique Sanglard. On n’en a décrit qu’environ 5% et, parmi elles, 500 à 600 espèces sont pathogènes pour l’être humain.»
Sous nos latitudes, les plus fréquentes sont celles qui appartiennent au genre Candida. À commencer par Candida albicans, un micro-organisme «opportuniste» que le chercheur compare à «Dr Jekyll et Mr Hyde». Comme le héros du livre de Robert Louis Stevenson, ce bon médecin qui, la nuit venue, devient un monstre, il présente une double face. Il est relativement inoffensif quand il adopte la forme lévurique (qui, comme la levure du boulanger, «ressemble à un petit bonhomme de neige»). Mais il devient «beaucoup plus virulent et inflige des lésions aux tissus» lorsqu’il prend une forme filamenteuse (il est alors constitué d’une cellule prolongée par des filaments). Contrairement au Dr Jekyll qui avait concocté une potion pour scinder son âme en deux, C. albicans, lui, trouve dans son hôte, sans lequel il ne peut pas vivre, «les conditions – température corporelle, éléments nutritifs etc. – qui favorisent sa transformation».
Devenu pathogène, il provoque des candidoses qui peuvent être superficielles, comme lorsqu’il colonise la bouche des nouveau-nés et engendre le muguet. Mais lorsqu’il «passe la barrière physiologique de la peau et qu’il s’introduit dans la circulation sanguine, il peut se propager dans divers tissus et des organes vitaux». Les candidoses sont alors dites invasives et elles «?sont mortelles dans 40 à 60% des cas. Elles tuent environ 400 000 personnes par an.»
De grandes quantités de spores inhalées
«Le tueur numéro 2» dans nos contrées est Candida glabrata. Contrairement à C. albicans, il ne produit pas de filaments, mais il n’en est pas moins aussi mortel que lui. «On le craint, précise le microbiologiste de l’UNIL, parce qu’il peut développer très rapidement des résistances aux traitements antifongiques classiques.»
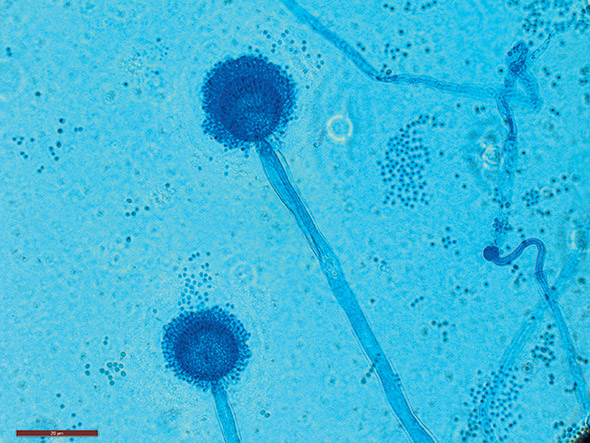
Vient ensuite Aspergillus fumigatus qui, lui, est présent dans l’environnement. Il disperse énormément de spores dans l’air. «On en inhale d’importantes quantités par exemple lorsqu’on retourne des composts – dans lesquels il s’accumule, car il résiste bien à la chaleur issue de la décomposition des matières organiques.» Il est aussi dangereux à l’hôpital quand il s’attaque aux patients dont le système immunitaire est affaibli. Il peut alors pénétrer dans les sinus, les poumons ou même atteindre le cerveau. «Les aspergiloses invasives sont très difficiles à combattre et leur pronostic est généralement mauvais.»
À cette liste des champignons tueurs, on pourrait en ajouter bien d’autres. Notamment les micro-organismes du genre Cryptococcus. L’un d’eux, C. neoformans, qui sévit surtout dans les pays en développement, se transmet de l’environnement à l’être humain, via le guano des pigeons. Une fois inhalés, ses spores «atteignent spécifiquement le système nerveux central et provoquent des méningites», explique Dominique Sanglard. Quant à C. gattii, il est présent dans les sols ou en suspension dans l’air. L’une de ses souches, très agressive, fréquente dans les régions tropicales et substropicales, a émergé à Vancouver au Canada, au début des années 2000. Infectant le poumon et le cerveau, elle a d’autant plus inquiété qu’elle «a affecté des personnes immunocompétentes», c’est-à-dire dont le système immunitaire n’était pas altéré.
Moyens de lutte limités
Le traitement de ces diverses maladies provoquées par des champignons passe par des médicaments antifongiques. Il en existe quatre classes, aux modes d’action très différents, «mais seules trois d’entre elles sont fréquemment utilisées», précise Dominique Sanglard. La plus ancienne – elle a été mise sur le marché dans les années 50 – est celle des polyènes. Ces substances naturelles déstabilisent la membrane des champignons en se fixant à l’un de ses composants, l’ergostérol. Apparus plus récemment, les azoles «affectent la production de l’ergostérol», indispensable à la vie du micro-organisme. Enfin, les derniers en date des antifongiques – ils ont été commercialisés dans les années 2000 – sont les candines qui «tuent le champignon en perturbant la biosynthèse de sa paroi».
Même si chacune de ces classes comporte plusieurs molécules, «il y a assez peu de médicaments disponibles. Nos moyens de lutte contre les infections fongiques restent donc limités», constate le microbiologiste.
La résistance aux médicaments: une épée de Damoclès
Cela pose «un gros problème» car, de même que de nombreuses bactéries deviennent insensibles aux antibiotiques, les champignons se mettent, eux aussi, à faire de la résistance aux antifongiques. «C’est inéluctable, souligne le professeur de l’UNIL. Après un certain temps d’exposition aux médicaments, on observe une sélection des organismes qui y résistent.» Les champignons ne font pas exception à la règle, même si «la transmission de la résistance d’un micro-organisme à un autre, qui est fréquente chez les bactéries, n’existe pas en tant que telle dans les champignons». Chez eux, l’émergence et la dispersion de la résistance est donc «beaucoup moins rapide».
L’ampleur du phénomène varie d’ailleurs selon l’espèce du micro-organisme et le pays concerné. «Entre 1 à 5% des Candida albicans sont insensibles aux azoles, contre 10 à 15% des Candida glabrata. Pour Aspergillus fumigatus, la proportion s’élève à plus de 25% aux Pays-Bas, mais elle est bien moindre en Suisse.» On commence même à voir apparaître des champignons devenus insensibles à deux antifongiques ou même, comme Candida auris, à l’ensemble des médicaments existants. «Le phénomène s’étend non seulement aux champignons pathogènes pour l’être humain, mais aussi à ceux qui touchent les plantes d’intérêt agronomique. À l’avenir, il va certainement s’amplifier», prédit Dominique Sanglard qui le qualifie «d’épée de Damoclès».
© Institut de microbiologie UNIL-CHUV
L’agriculture intensive pointée du doigt
Comme ses collègues britanniques avec lesquels il a lancé récemment une mise en garde dans la revue Science, le chercheur lausannois considère que l’une des causes de la résistance d’Aspergillus fumigatus est l’intensification de l’agriculture. Certaines substances, en particulier les azoles, sont en effet utilisées à la fois comme fongicides, pour protéger les cultures, et comme antifongiques en médecine humaine.
«Les trace de ces produits se retrouvent dans les sols ou dans les composts. Lorsqu’un champignon entre accidentellement en contact avec eux, il arrive qu’il devienne résistant. Ensuite, il disperse ses spores et peut coloniser les êtres humains.»
Les chercheurs de l’Institut de microbiologie, en collaboration avec leurs collègues des Hôpitaux universitaires de Genève et de l’Agroscope de Changins, en ont fait la preuve en récoltant, en 2016 et 2017, des échantillons de sol dans l’Arc lémanique. «10% d’entre eux contenaient des champignons de l’espèce Aspergillus fumigatus résistants aux azoles, alors que lors d’une précédente étude, réalisée en 2000, nous n’en n’avions trouvé aucun. Cela est dû au fait que l’agriculture utilise beaucoup plus d’azoles qu’auparavant.» En outre, explique Dominique Sanglard, «nous avons retrouvé les mêmes signatures génétiques dans ces micro-organismes résistants extraits des sols et dans ceux qui infectent des patients».
Exploration de nouvelles pistes
Que faire? Difficile de modifier les pratiques de l’agriculture «qui ne peut pas renoncer immédiatement aux fongicides», admet le microbiologiste. Quant à attendre que l’industrie pharmaceutique élabore de nouveaux antifongiques, il y a peu d’espoir dans la mesure où «elle fait très peu de recherches dans ce domaine».
Il reste donc à se tourner vers la recherche fondamentale pour innover. Dominique Sanglard et ses collègues ont entrepris d’explorer «des substances d’origine naturelle que les plantes produisent pour combattre les champignons». En collaboration avec leurs collègues de l’Université de Genève, ils en ont déjà trouvé une, la tomatidine. Pour l’instant, l’affaire en est restée au niveau académique, car «il est difficile de trouver des partenaires industriels pour assurer le développement de cette molécule».
Une autre piste explorée à l’Institut de microbiologie, est «de s’attaquer aux acteurs cellulaires qui jouent un rôle important dans le développement de la résistance». Avec des collègues américains de l’Université de Harvard, les chercheurs ont passé au crible 150 000 molécules parmi lesquelles ils en ont identifié «cinq qui étaient potentiellement intéressantes», pour finalement n’en retenir qu’une, qu’ils ont brevetée.
Ils ont aussi découvert que certaines substances étaient capables d’inhiber «la pompe d’efflux, qui est une sorte de pompe utilisée par les champignons pour évacuer les antifongiques de leurs cellules?. Ces produits, déjà utilisés en médecine vétérinaire pour combattre les parasites, pourraient eux aussi contribuer à combattre le phénomène de résistance.
La mycologie, parent pauvre de la microbiologie
Bien d’autres voies sont explorées et les laboratoires de différents pays ne manquent pas d’idées pour lutter contre les champignons pathogènes. Une équipe américaine de l’Université de Californie a même élaboré un vaccin, qui est en cours d’essais cliniques, contre les vaginites dues à C. albicans – «une maladie qui affecte chaque année 100 millions de femmes dans le monde», précise Dominique Sanglard.
La course est lancée et, dans le domaine des champignons pathologiques, l’Institut de microbiologie «a des compétence uniques en Suisse», selon le professeur lausannois. Il constate toutefois que «la mycologie reste le parent pauvre de la microbiologie». Il y a pourtant fort à faire pour combattre les maladies fongiques qui, outre qu’elles mettent en danger la vie de patients, «coûtent très cher aux hôpitaux», conclut-il.



