Utilisé pour fabriquer des vaccins contre la Covid-19, l’ARN pourrait demain être employé dans la prévention d’autres maladies infectieuses. Mais son intérêt ne s’arrête pas là. Il existe toute une famille d’ARN dont des membres pourraient fournir de nouvelles armes contre de multiples pathologies, du diabète aux maladies cardiovasculaires, en passant par les cancers. Avec eux, l’histoire de la médecine est à un nouveau tournant.
L’ARN fait la Une de l’actualité. À juste titre, puisqu’il est au centre des premiers vaccins commercialisés en Suisse contre la Covid-19. Mais derrière ces trois lettres – A, R, N – se cache en fait toute une famille d’acides ribonucléiques.
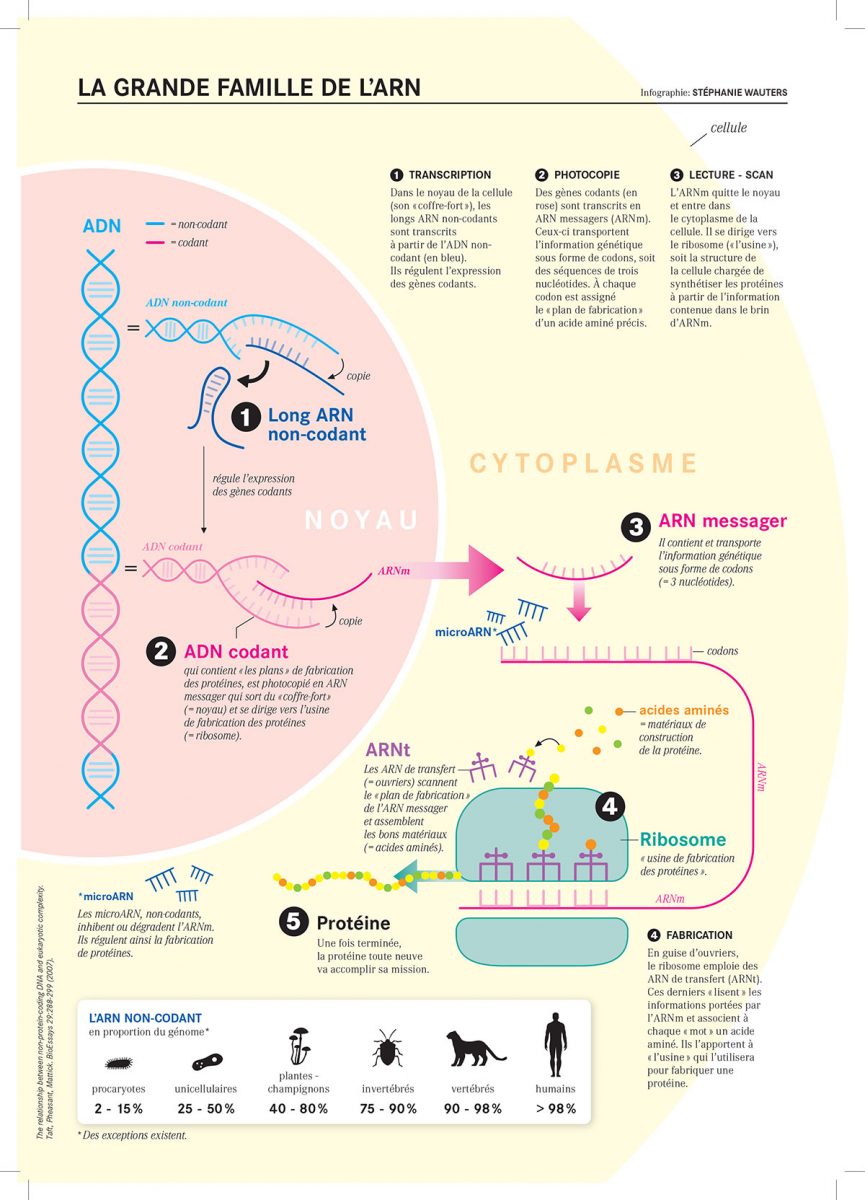
Les ARN messagers recopient l’information génétique
Ceux qui sont dans toutes les bouches actuellement sont les ARN messagers (ARNm), puisque ce sont eux qui sont utilisés dans la fabrication des vaccins de Pfizer-BioNTech et Moderna. Ils sont aussi les mieux connus des biologistes qui ont depuis longtemps compris leur rôle.
Comme leur nom l’indique, ils transportent des informations, cruciales de surcroît : il s’agit de celles contenues dans l’ADN. On le sait, cette longue molécule en forme de double hélice est précieuse, puisqu’elle renferme le plan de fabrication des protéines. Elle reste donc enfermée dans un coffre-fort, le noyau de la cellule. Les ARNm sont chargés de recopier ses instructions et de les transmettre aux ribosomes qui, dans la cellule, sont les usines de fabrication des protéines.
Si nous, béotiens, les découvrons aujourd’hui, leurs éventuelles applications cliniques «sont en fait étudiées depuis une vingtaine d’années, souligne Blaise Genton, chef du Département formation, recherche, innovation et responsable de la vaccination d’Unisanté (Centre universitaire de médecine générale et santé publique à Lausanne). On a d’abord songé à eux pour produire des vaccins thérapeutiques contre le cancer et, depuis environ cinq ans, pour prévenir des maladies infectieuses, comme le chikungunya et l’infection au virus Zika.»

Vaccins à ARN: faciles à fabriquer et à modifier
C’est toutefois dans la lutte contre le coronavirus qu’ils ont trouvé leur première application concrète. Alors que les vaccins traditionnels «renferment des fractions du virus tué ou à l’activité atténuée afin de générer des réponses immunes contre des protéines “étrangères”», précise Blaise Genton, les vaccins les plus récents poussent nos propres cellules à faire le travail.
Certains, comme celui d’AstraZeneca, emploient un vecteur viral. «Il s’agit du virus du rhume du chimpanzé, explique Blaise Genton. On supprime la séquence génétique responsable de sa réplication, puis on la remplace par le code génétique de la protéine Spike du coronavirus, la clé qui lui permet d’entrer dans la cellule.» D’autres, les plus innovants, font appel à un ARNm synthétique «qui est enrobé dans une capsule de lipides car sinon, il serait détruit avant même d’entrer dans la cellule», explique le médecin d’Unisanté. Cet ARNm porte les instructions nécessaires à la fabrication de la protéine Spike.
Ces vaccins à ARNm ont un point faible: ils sont fragiles. Ils doivent donc être conservés à très basse température, «ce qui pourrait bientôt changer, si l’on parvient à augmenter leur stabilité», précise Blaise Genton. Ils ont en revanche d’énormes avantages. Ils sont plus simples et plus rapides à fabriquer que leurs homologues traditionnels. «Surtout, en modifiant quelques acides nucléiques des ARNm (briques à l’aide desquelles ils sont constitués, ndlr), il est possible de les modifier rapidement lorsque de nouveaux variants du virus circulent.» On devrait donc pouvoir les utiliser pour prévenir bien d’autres maladies infectieuses, y compris la grippe.
Les «non-codants» issus d’une prétendue «poubelle»
Dans la longue molécule qui forme l’ADN, les gènes qui portent le plan de fabrication de protéines – les biologistes disent qu’ils «codent» pour les protéines – ne sont que 20000. Ils ne représentent que 2% de l’ensemble de notre génome. Le reste a longtemps été qualifié «d’ADN poubelle», car il était constitué de gènes, dits non-codants, «qui étaient considérés comme ne servant à rien. On les voyait comme de simples déchets qui se sont accumulés au cours de l’évolution», constate Romano Regazzi, professeur à l’UNIL, directeur du Département des sciences biomédicales et vice-directeur de l’École de médecine.

En fait, cette prétendue poubelle est fort utile. «Elle produit des ARN dits non-codants qui servent à réguler l’expression des gènes codants pour les protéines.» En d’autres termes, elle est à ces derniers ce qu’un variateur est à la lumière: elle les allume avec plus ou moins d’intensité ou les éteint.
Étonnamment, constate Thierry Pedrazzini, professeur associé à l’UNIL et directeur de l’unité de cardiologie expérimentale du Service de cardiologie du CHUV, «le nombre de gènes codants est pratiquement le même dans toutes les espèces animales. Mais plus on monte dans la hiérarchie de l’évolution, plus la proportion de gènes non-codants augmente. Ces derniers sont donc à l’origine de la complexité des organismes.» Pour illustrer ce phénomène, le professeur prend l’exemple des notes de musique. «Nous avons tous les mêmes sept notes à notre disposition, pourtant lorsque Mozart en jouait, le résultat était fabuleux du fait de sa complexité, alors que quand je me mets au piano, ajoute-t-il en riant, c’est tout autre chose!»
Certains de ces ARN non-codants étaient connus depuis longtemps, comme les ARN de transfert et les ARN ribosomiques (lire encadré ci-dessous). Mais «la grande révolution, précise Thierry Pedrazzini, est intervenue il y a une dizaine d’années, lorsqu’on a pu séquencer l’ensemble de ces ARN cellulaires. On en a alors découvert bien d’autres.»
Ils sont classés en deux catégories, en fonction de leur taille: les courts, qui ont moins de 200 nucléotides (unités de construction des acides nucléiques), les longs, qui en ont plus.
Les microARN interviennent dans le diabète
Parmi les courts, les plus connus sont les microARN (miARN) formés d’une vingtaine de nucléotides. «Ils se lient à des régions particulières des ARN messagers dont ils inhibent l’action, les empêchant de produire des protéines», explique Romano Regazzi.
Ils ont été découverts pour la première fois dans un petit ver, Caenorhabditis elegans, très utilisé par les biologistes comme organisme modèle. Aujourd’hui, on sait que les cellules des mammifères en possèdent aussi. «Des milliers d’entre eux ont déjà été identifiés et l’on estime qu’ils pourraient contrôler 30 à 50% des gènes humains. Ils sont donc probablement impliqués dans un grand nombre de fonctions physiologiques et de conditions pathologiques.»
En particulier dans le diabète de type 1. Les enfants et les jeunes adultes qui en souffrent manquent d’insuline parce que les cellules bêta du pancréas qui produisent l’hormone sont détruites par le système immunitaire. «Ce dysfonctionnement est lié à des changements dans le niveau d’expression de certains microARN», explique Romano Regazzi. Son équipe a en effet découvert que, dans le diabète de type 1, les «lymphocytes (composants du système immunitaire) qui infiltrent le pancréas relâchent des vésicules qui transfèrent certains de leurs microARN dans des cellules bêta, ce qui les tue».
Diabète freiné chez la souris
En utilisant une molécule qui bloque l’action de ces microARN destructeurs, Romano Regazzi et ses collègues ont réussi à «prévenir la mort de cellules bêta, donc à freiner le développement du diabète de type 1 chez des souris». Bien qu’un même mécanisme intervienne chez l’être humain, «on ne peut pas transposer ce traitement en clinique, car nous avons utilisé des virus pour mener nos expériences. Il faudra donc trouver un autre moyen d’introduire cette molécule dans les cellules bêta, indique le vice-directeur de l’École de médecine. Par ailleurs, chez les rongeurs, nous avons réussi à intervenir avant l’apparition du diabète. On ne sait pas si la méthode fonctionnera quand la maladie s’est déjà déclarée.»
Ces ARN pourraient aussi servir de biomarqueurs. De nombreuses cellules de l’organisme relâchent en effet des vésicules contenant des microARN que l’on retrouve ensuite dans le sang, l’urine et autres fluides biologiques où l’on peut les quantifier. Ces mesures pourraient permettre par exemple «d’identifier une personne qui va développer un diabète ou de prédire qu’une autre, ayant déjà cette maladie, est à risque d’avoir des complications».

Les longs ARN non-codants jouent les modérateurs
Les longs ARN non-codants sont plus nombreux que les courts – «on en a déjà identifié environ 200000», selon Thierry Pedrazzini – mais l’intérêt qu’ils suscitent est plus récent. Eux aussi jouent les modérateurs. «Ils s’associent à des partenaires – un ARN, l’ADN ou une protéine – et régulent l’expression des gènes codants.» Certains ont un effet local, d’autres agissent sur des gènes situés beaucoup plus loin dans le génome, d’autres encore peuvent sortir du noyau et intervenir dans le reste de la cellule, le cytoplasme. «Un seul long ARN non-codant peut cibler plusieurs gènes et ainsi orchestrer la réponse de la cellule induite par divers stimuli, un stress ou une maladie par exemple», explique le professeur de l’UNIL. En résumé, «ils sont les régulateurs de l’identité et du comportement cellulaires». Cela ouvre de vastes perspectives thérapeutiques puisque, en intervenant sur ces chefs d’orchestre, on peut inciter une cellule à réagir de façon appropriée face à une pathologie.
Réparer le cœur après un infarctus
L’équipe de Thierry Pedrazzini a choisi d’en tirer parti pour tenter de régénérer le muscle cardiaque après un infarctus du myocarde. Privées de sang et d’oxygène lors de l’attaque, les cellules du muscle cardiaque, les cardiomyocytes, meurent. Par ailleurs, on assiste à la prolifération de fibroblastes, des cellules rigides qui forment des cicatrices fibreuses. Du fait de ce double processus, le cœur a donc plus de difficultés à se contracter et à jouer son rôle de pompe.
«Les médicaments utilisés actuellement ralentissent la destruction des cellules cardiaques, mais ils ne permettent pas leur régénération», constate le chercheur. D’où son idée d’utiliser un long ARN non-codant qui agit comme un «interrupteur moléculaire. Grâce à lui, on peut reprogrammer le cardiomyocyte et le pousser à faire une chose pour laquelle il n’est pas conçu: proliférer, donc produire de nouvelles cellules.»
En «éteignant» l’un de ces ARN, Wisper, chez la souris, les chercheurs de l’UNIL ont réussi à limiter la fibrose et à permettre au cœur de se réparer plus vite après un infarctus.
Exploitant le fait que «les longs ARN non-codants sont facilement accessibles et qu’il est donc possible de bloquer leur action à l’aide d’inhibiteurs», l’équipe lausannoise a tenté l’expérience. Elle a utilisé un petit fragment d’ADN (nommé GapmeR) qu’il est possible de modifier, afin qu’il détruise spécifiquement une cible – en l’occurrence, l’ARN Wisper exprimé uniquement dans les fribroblastes. «Chez la souris, deux injections suffisent à accélérer la récupération du cœur.» Les chercheurs ont d’ailleurs breveté leur procédé et créé une start-up pour le développer. «Avec l’espoir, dit Thierry Pedrazzini, d’en faire un traitement.»
Essais cliniques dans trois ans
Une équipe allemande a récemment «apporté la preuve de la faisabilité de la méthode chez l’être humain», souligne Thierry Pedrazzini qui envisage de lancer des premiers essais cliniques dans trois ans.
Ces longs ARN non-codants étant «impliqués dans toutes les maladies», ils pourraient, eux aussi, servir de biomarqueurs ou encore «de cibles pour de nouveaux traitements, y compris dans le domaine des pathologies neurologiques dégénératives», note Thierry Pedrazzini.
La saga de la famille des ARN non-codants ne fait donc que commencer. «Lorsque l’on aura compris comment ils fonctionnent, ce qui est loin d’être le cas pour la plupart d’entre eux, on pourra mieux élucider les causes de certaines maladies et peut-être trouver d’autres approches pour les traiter», espère Romano Regazzi. De quoi bouleverser le monde de la médecine.
Applications médicales de l’ARN non-codant
ARN messager, microARN et long ARN non-codant ne sont que quelques illustres représentants de la famille des ARN qui en compte bien d’autres. Notamment:
• Les ARN ribosomiques (ARNr). Au cours de la succession d’étapes qui conduit à la fabrication des protéines, ils interviennent après leurs collègues messagers dont ils traduisent l’information, afin de permettre au ribosome de produire les protéines.
Dans la lutte contre le cancer, «on pourrait agir sur eux pour bloquer le mécanisme biologique dont dispose la cellule tumorale pour proliférer, précise Thierry Pedrazzini. Mais il faudrait pouvoir les cibler spécifiquement, sinon, on n’est pas à l’abri des effets secondaires.»
Une entreprise canadienne en a déjà fait un outil susceptible de déterminer rapidement le succès d’une chimiothérapie anti-cancéreuse. Si l’ARNr présent dans les cellules tumorales est disloqué, la production des protéines est impossible et les cellules meurent. Dans le cas contraire, le médicament est inefficace.
• Les ARN de transfert (ARNt). L’ARN messager porte l’information sous forme de mots de trois lettres (codons) qui, chacun, représente le plan de fabrication d’un acide aminé, donc d’une des briques qui forment les protéines. Il revient à l’ARNt de lire le message, d’associer à chaque mot un acide aminé et d’apporter celui-ci au ribosome, l’usine de production des protéines.
• Les ARN interférents (siARN). Ils ont été découverts en 1990 à l’occasion d’expériences sur les plantes. Huit ans plus tard, deux chercheurs américains ont élucidé leur fonction chez le ver Caenorhabditis elegans, ce qui leur a valu de recevoir le Prix Nobel de médecine et de physiologie en 2006.
Ces petits ARN non-codants inhibent les ARN messagers et bloquent les gènes dont ceux-ci sont issus. Ils constituent donc un outil de choix pour «éteindre» un gène impliqué dans une maladie.
Un premier médicament à base de siARN a été mis sur le marché aux États-Unis en 2018 pour traiter l’amylose héréditaire, une neuropathie dont ils freinent l’évolution. Un autre, destiné au traitement de la DMLA (dégénérescence maculaire liée à l’âge), est en cours d’essais cliniques. On compte aussi beaucoup sur eux pour enrichir la panoplie des thérapies anti-cancéreuses.



