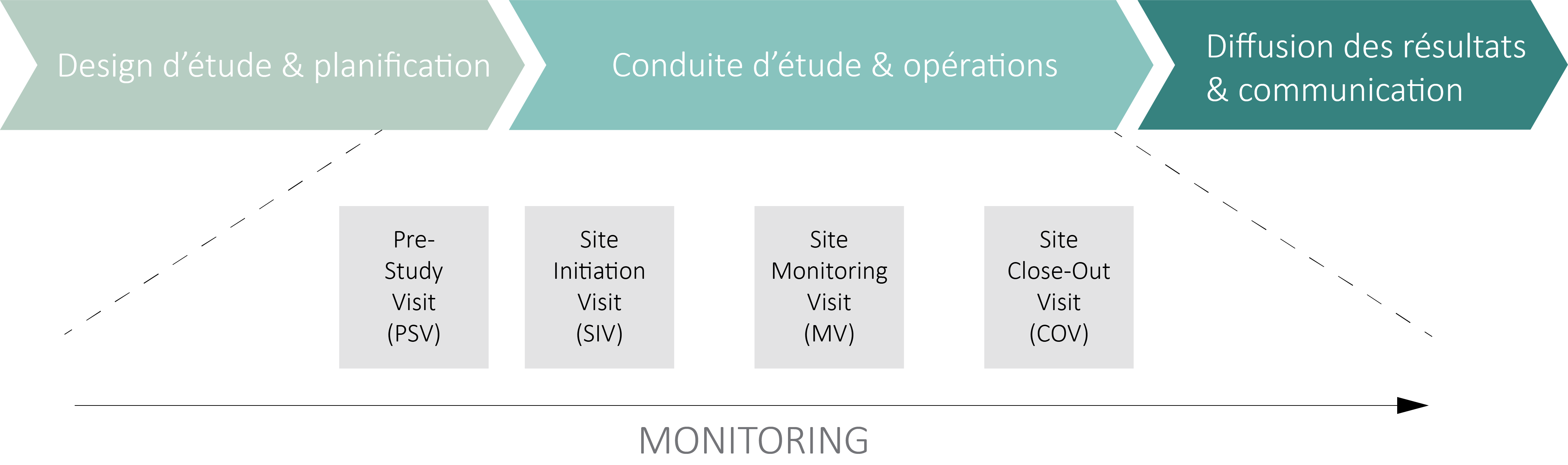
L’ activité de monitoring a pour but de garantir que les droits et le bien-être des sujets sont protégés, et que les données de l’essai clinique (OClin) ou de l’essai clinique avec un dispositif médical (OClin-Dim) saisies dans la base de données sont exactes, complètes et vérifiables à partir des documents sources.
Elle supervise également le déroulement d’un essai clinique ou d’un essai avec un dispositif médical et veille à ce qu’il soit mené, enregistré et rapporté conformément au protocole d’étude, aux documents de qualité applicables, aux Bonnes Pratiques Cliniques (BPC) (ICH E6 GCP 5.18) et aux réglementations en vigueur.
Contactez-nous pour en savoir plus sur la manière dont le monitoring doit être mis en place.

